Hóa học luôn là một trong những môn học khó trong chương trình học cơ sở, chính vì thế để có thể học tốt bạn không thể bỏ qua dãy điện hóa của kim loại . Bạn đang muốn tìm hiểu làm thế nào để có thể học thuộc nhanh chóng dãy điện hóa thì hôm nay Legoland xin chia sẻ cho mọi người mẹo học nhanh chóng không mất quá nhiều thời gian nhé .
Trước tiên đi vào mẹo học thuộc dãy điện hóa kim loại thì chúng ta cần phải hiểu về nó trước nhé .
Dãy điện hóa là gì?
Dãy điện hóa kim loại chính là dãy hoạt động hóa học của kim loại có ý nghĩa, vai trò quan trọng trong sự phát triển của lĩnh vực hóa học. Dãy hoạt động hóa học của kim loại gồm dãy các kim loại được sắp xếp theo thứ tự, thứ tự này phụ thuộc vào mức độ hoạt động của kim loại (tức là khả năng tham gia phản ứng hóa học với chất khác).
Điện hóa kim loại là gì?
Trong phản ứng hóa học, cation kim loại có thể nhận electron để trở thành nguyên tử kim loại và ngược lại, nguyên tử kim loại có thể nhường electron để tạo thành cation kim loại.
Cụ thể như:
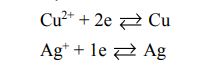
Tính chất của điện hóa
Tính oxi hóa của ion Mn+ càng mạnh thì tính khử của kim loại M càng yếu và ngược lại (tính oxi hóa của ion Mn+ càng yếu thì tính khử của kim loại M càng mạnh).
Cụ thể như:
+ Kim loại Na có tính khử mạnh do đó ion Na+ có tính oxi hóa yếu.
+ Ion Ag+ có tính oxi hóa mạnh do đó kim loại Ag có tính khử yếu.
Ý nghĩa điện hóa của kim loại đầy
So sánh tính oxi hóa – khử của điện hóa
– Tính oxi hóa của ion Mn+ càng mạnh thì tính khử của kim loại M càng yếu và ngược lại (tính oxi hóa của ion Mn+ càng yếu thì tính khử của kim loại M càng mạnh).
– Cụ thể như:
+ Kim loại Na có tính khử mạnh do đó ion Na+ có tính oxi hóa yếu.
+ Ion Ag+ có tính oxi hóa mạnh do đó kim loại Ag có tính khử yếu.
Xác định chiều phản ứng oxi hóa – khử của điện hóa
Dãy điện hóa của kim loại cho phép dự đoán chiều của phản ứng giữa hai cặp oxi hóa – khử theo quy tắc alpha (α): Phản ứng giữa hai cặp oxi hóa – khử sẽ xảy ra theo chiều chất oxi hóa mạnh hơn sẽ oxi hóa chất khử mạnh hơn, sinh ra chất oxi hóa yếu hơn và chất khử yếu hơn.
Xét một phản ứng oxi hóa – khử xảy ra hay không
Để xét một phản ứng oxi hóa – khử có xảy ra hay không cần nắm được quy tắc alpha: Chất khử mạnh + chất oxi hóa mạnh → chất oxi hóa yếu hơn + chất khử yếu hơn.
Bảng điện hóa thông dụng đáng nhớ :
Mẹo học thuộc bảng điện hóa kim loại đầy đủ
Chúng ta học thuộc dãy điện hóa kim loại bằng câu vè như sau .
Ngoài ra nếu những ai thích thể loại thơ và đam mê thơ những lại thích học hóa học thì có thể áp dụng câu thơ vào học thuộc dãy điện hóa kim loại như sau nhé .
Tiêu đề bài thơ : MẤY LỜI VỀ DÃY ĐIỆN HÓA
Dãy điện hóa O sau khử trước (1)
Phản ứng theo quy ước alpha
Nhưng cần phải hiểu sâu xa
Trước sau ý nghĩa mới là thành công
Kali, Can, Nát tiên phong
Ma, Nhôm, Man, Kẽm tiếp không chịu hèn
Sắt rồi Cô đến Niken
Thiếc, Chì dẫu chậm cũng liền theo chân
Hiđro, Đồng, Bạc, Thủy ngân,
Bạch kim, Vàng nữa chịu phần đứng sau.
Ba kim (loại) mạnh nhất ở đầu
Vào dung dịch muối nước đâu “hủy liền”.
Khí bay, muối lại gặp kiềm,
Đổi trao phản ứng là quyền chúng thôi.
Các kim loại khác dễ rồi,
Vào dung dịch muối trước thời đẩy sau.
Với axit, nhớ bảo nhau :
Khử được hát cộng (H+), phải đâu dễ dàng.
Từ Đồng cho đến cuối hàng,
Sau Hiđro đấy, chẳng tan chút nào.
Vài lời bàn bạc, đổi trao,
Vun cây “Vườn Hóa” vui nào vui hơn
5 Ví dụ hay về điện hóa
Ví dụ 1 :
Cu2++Fe→Fe2++Cu (kết tủa)
Tuy nhiên, quy tắc α cũng có những trường hợp ngoại lệ.
Cụ thể:
Các kim loại kiềm đầu dãy sẽ không khử kim loại. Mà ngược lại, chúng sẽ khử nước.
Ví dụ2 :
Ca+2H2O→Ca(OH)2+H2.
Các kim loại từ Mg đến trước Hidro, khi tác dụng với dung dịch axit sẽ tạo ra muối và giải phóng khí hidro.
Ví dụ 3 :
Zn+2HCl→ZnCl2+H2
Al, Fe, Cr sẽ không có phản ứng với HNO3 đặc nguội và H2SO4 đặc nguội.
Các kim loại cuối dãy (Au, Pt,…) ko tác dụng được với axit. Đây cũng là một cách để kiểm tra vàng.
Ví dụ 4 :
Xác định thế điện cực chuẩn của cặp Ag+ / Ag. Lắp pin điện hoá Ag – H2. Bạc là cực (+), hiđro là cực (-). Khi pin hoạt động
- Cực (-): H2 → 2H+ + 2e
- Cực (+): Ag + e → Ag
Phương trình oxi hóa – khử trong pin điện hoá:
Vôn kế là +0,80V. Do đó E°(Ag+ / Ag) = +0,80V
Ví dụ 5 :
Biết suất điện động chuẩn của pin điện hóa Zn – Ag là 1,56 V và thế điện cực chuẩn của cặp oxi hóa – khử Ag+/Ag là +0,80 V.
Hãy xác định thế điện cực chuẩn của cặp Zn2+/Zn ?
Lời giải : Ta có Eopin = EoAg+/Ag – EoZn2+/Zn → EoZn2+/Zn = EoAg+/Ag – Eopin = +0,80 – 1,56 = –0,76 V













