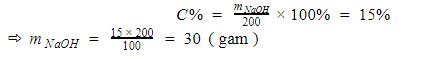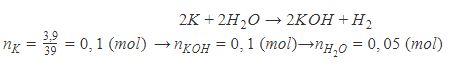Các môn học khoa học tự nhiên (toán học – hóa học – vật lý), luôn là những nỗi ám ảnh, những áp lực vô hình đối với các em học sinh. Bài viết sau đây, sẽ giúp các bạn ôn lại kiến thức về một trong những công thức phổ biến nhất của môn hóa học, chính là công thức tính nồng phần trăm. Thông qua bài viết này, cũng với một số ví dụ, các bạn sẽ biết được cách tính nồng độ phần trăm là gì? và cách vận dụng vào bài tập để đạt được điểm số mong muốn trong các kì thi sắp tới nhé!
Hiểu thế nào là nồng độ?
Hiểu theo một cách đơn giản thì thuật ngữ nồng độ được dùng để biểu thị lượng hóa chất có trong một hỗn hợp, và phần lớn hầu hết các hỗn hợp đó đều tồn tại dưới dang dung dịch. Cấu tạo thông thường của một dung dịch thường gồm 2 phần: chất tan và dung môi.
Nồng độ trong một dung dịch có thể điều chỉnh để tăng lên bằng cách giảm lượng dung môi hoặc tăng lượng chất tan và làm ngược lại nếu như muốn giảm nồng độ của dung dịch.
Nồng độ là gì?
Trong trường hợp, ta thêm chất tan vào dung dịch nhưng dung dịch không thể hòa tan chất tan (nào) nữa. Lúc đó, ta gọi là dung dịch bão hòa. Cũng tại thơi điểm đó, nồng độ của dung dịch cũng đạt mức cao nhất.
Một số loại (khái niệm) về nồng độ mà ta thường gặp:
- Nồng độ phân tử gam hay nồng độ chuẩn: công thức tính nồng độ này thường được áp dụng cho những phản ứng hóa học lên quan đến dung dịch axit và bazo.
- Nồng độ phần trăm của khối lượng,
- Nồng độ phần trăm của thể tích,
- Nồng độ mol (ký hiệu).
Tiếp theo đây, chúng ta hãy cùng nhau tìm hiểu về khái niệm nồng độ phần trăm là gì? Đây chính là cơ sở để chúng ta có thể giải được câu hỏi về tính nồng độ phần trăm là gì?
Tham khảo thêm một số công thức hóa học :
- Công thức tính nồng độ mol chuẩn cho dung dịch
- CH4 ra C2H2: Cách điều chế axetilen từ metan chuẩn
- FE2O3 + H2SO4 đặc nóng có ra SO2 không?
Thế nào là nồng độ phần trăm?
Nồng độ phần trăm là gì?
Nồng độ phần trăm của một dung dịch, được ký hiệu là C%, đây chính là đại lượng cho ta biết được số gam (g) chất tan tồn tại, có trong 100g dung dịch.
Từ đó, ta có thể hiểu một cách tương tự về nồng độ phần trăm theo thể tích. Vậy, nồng độ phần trăm theo thể tích chính là đại lượng cho ta biết được có bao nhiêu mili lít (ml) chất tan có trong 100ml dung dịch đó.
Trước khi đi tìm câu trả lời cho câu hỏi công thức nồng độ phần trăm là gì?, ta cùng điểm qua một vài lưu ý trước khi muốn áp dụng công thức tính nồng độ phần trăm trước nhé!
Một số điều cần lưu ý trước khi sử dụng công thức tính nồng độ phần trăm:
Để có thể đưa ra đáp án, kết quả một cách chính xác nhất cho các bài tập tính toán về nồng độ phần trăm, các bạn cần phải chú ý những điều sau đây:
- Cần phải lưu ý đọc thật kí đề bài, tóm tắt những thông tin, số liệu về thành phần, dung dịch mà đề bài đã cho một cách cẩn thận để có thể tiên hành tính toán đưa ra đáp án đúng nhất.
- Phải ghi nhớ rõ từng công thức khác nhau có liên quan đến nồng độ tính phần trăm để tránh nhằm lần, dẫn đến việc áp dụng sau công thức → sai kết quả.
- Sau khi thực hiện hai bước trên xong, cần tính toán, nhập số liệu công thức vào máy tính một cách cẩn thân để tránh việc nhập sai số liệu, nhập nhầm công thức. Cuối cùng, kiểm tra lại đáp án một lần nữa trước khi đưa ra kết quả cuối cùng.
Sau khi đã ghi nhớ vài lưu ý trên thì tiếp theo, chúng ta đã có đủ cơ sở để tìm hiểu cách tính nồng độ phần trăm?
Công thức tính nồng độ phần trăm
Công thức tính nồng độ phần trăm?
Công thức nồng độ phần trăm được xác định bằng thương giữa khối lượng chất tan với khối lượng dung dịch với tích của một trăm phần trăm. Trong đó:
- C%: là ký hiệu của nồng độ phần trăm,
- m chất tan: là khối lượng của thành phần chất tan,
- m dung dịch : là khối lượng cua dung dịch.
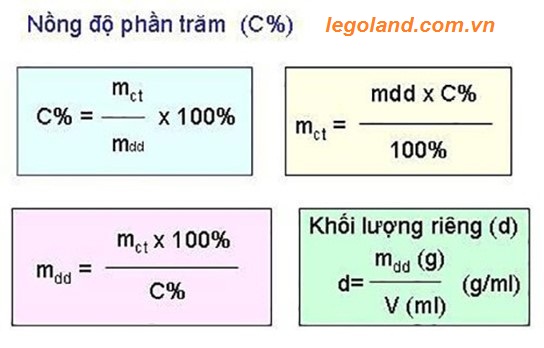
Công thức tính khối lượng của dung dịch:
Các bước để giải bài tập hóa về công thức tính dung dịch nồng độ mol, %
Các dạng bài toán tìm nồng độ phần trăm trong hóa học rất phong phú, đa dạng, Nhưng chúng sẽ dễ dàng được các bạn xử lý gọn gàng nếu như các bạn nắm chắc cũng như thực hiện theo như các bước giải sau đây:
- Bước 1: Chính bước đọc đề và tóm lượt số liệu có trong thông tin của đề. Tại bước này các bạn cần phải nắm được số lượng các chất tồn tại trong dung dung dịch, đặc biệt phải xác định được các số dư của chất tham gia vào phản ứng.
- Bước 2: PHải xác định để tính toán được khối lượng của dung dịch sau khi đã phan gia phản ứng bằng phương pháp bảo toàn khối lượng trong hóa học (PPBTKL: tổng khối lượng số chất tham gia phản ứng bằng với tổng khối lượng của sản phẩm)
- Bước 3: Dựa vào các công thức hóa học có liên quan với đề bài để thực hiện việc tính (xác định) khối lượng chất tan.
- Bước 4: Áp dụng công thức nồng độ phần trăm để “xử lý” toàn bộ phần còn lại của bài toán.
Nếu các bạn áp dụng đầy đủ cũng như theo thứ tự 4 bước giải bài toán tính nồng độ phần trăm như trên, là các bạn có thể dễ dàng tìm ra đáp án chính xác cho bài tập của mình.
Tuy nhiên, không phải bài toàn nào cũng dễ dàng cho chúng ta đầy đủ các thông tin về số liệu khối lượng các chất. Vì thế, không chỉ áp dụng công thức tính nồng độ phần trăm mà ta còn phải biết khéo léo, sử dụng kết hợp các công thức, kiến thức hóa học khác trong quá trình học tập để giải các bài toán liên quan đến nồng độ phần trăm nhé!
Một số bài tập ví dụ về cách tính nồng độ phần trăm:
Bài tập 1:
Hãy xác định khối lượng của hợp chất NaOH trong 200 gam dung dịch NaOH 15%.
Giải:
Áp dụng tính nồng độ phần trăm ta có:
Kết luận: Vậy có 30 gam NaOH trong 200 gam dung dịch NaOh 15%
Bài tập 2:
Người ta hòa tan 20 gam muối với nước, thu được một dung dịch A có nồng độ phần trăm là 10%:
- Hãy xác định khối lượng dung dịch A sau khi hòa tan,
- Hãy cho biết, cần bao nhiêu gam nước cho việc hòa tan.
Lời bài giải:
Áp dụng tính phần trăm nồng độ ta có:
→ Khối lượng dung dịch A là 200g
Áp dụng phương pháp bảo toàn khối lượng, ta có:
→ Cần 180g nước để có thể hòa tan 20g muối, tạo ra 200g dung dịch.
Bài tập 3:
Hòa tan 3,9g Kali vào 36,2g nước, người ta thu được dung dịch A. Hỏi dung dịch A có nồng độ bao nhiêu?
Lời giải bài :
Cân bằng phương trình, ta có:
Áp dụng tính nồng độ phần trăm, ta có:
→ Nồng độ dung dịch A là 14%.